Land:
Eine ausgewogene Ernährung ist insbesondere für Kinder in den ersten Lebensjahren für ihre körperliche, geistige und emotionale Entwicklung relevant. Wir beleuchten im Folgenden den Einfluss der Ernährung auf den Stoffwechsel, die geistige Entwicklung, das Immunsystem und die Geschmacksentwicklung von Säuglingen und Kleinkindern.
Auf dieser Seite
Einfluss auf den Stoffwechsel
Übergewicht und damit einhergehende Folgeerkrankungen wie Typ-2-Diabetes und Herz-Kreislauf-Erkrankungen sind Probleme unserer Zeit. Die Ernährung der Mutter in der Schwangerschaft und während der Stillzeit und die Ernährung im ersten Lebensjahr sowie Kleinkindernährung spielen dabei eine zentrale Rolle.
Tatsächlich konnte bereits eine Vielzahl von Studien einen Zusammenhang zwischen erhöhter Gewichtszunahme im Säuglingsalter und Übergewicht in der späteren Kindheit nachweisen1; 2; 3; 4 und hat damit einen direkten Einfluss auf die Entwicklung bestimmter Erkrankungen und die Lebenserwartung. Aus diesem Grund sollte schon während der Schwangerschaft sowie von Geburt an ein Augenmerk darauf gerichtet werden, eine übermäßige Gewichtszunahme zu verhindern.
Eine Reihe von Studien weist darauf hin, dass Stillen im Vergleich zur Ernährung mit Muttermilchersatzprodukten mit einer niedrigeren Gewichtszunahme im ersten Lebensjahr assoziiert ist und das Risiko für Übergewicht und Folgeerkrankungen wie Typ-2-Diabetes und Herz-Kreislauf-Erkrankungen um 25 bis 40 % vermindern kann.
So zeigte eine Metaanalyse aus 23 Studien, dass Stillen im Vergleich zu Nichtstillen im Mittel zu einer 25%igen Reduktion des Risikos führt, im späteren Kindes- oder Erwachsenenalter Übergewicht zu entwickeln5 (siehe Abbildung 2).
 Abbildung 1: Metaanalyse zum Zusammenhang zwischen frühkindlicher Muttermilchernährung (Stillen) und dem Übergewichtsrisiko des Kindes im späteren Leben; dargestellt ist das relative Risiko (OR, odds ratio mit 95 % Konfidenzintervall): kombiniert: 0,75 (0,69 – 0,82)
Abbildung 1: Metaanalyse zum Zusammenhang zwischen frühkindlicher Muttermilchernährung (Stillen) und dem Übergewichtsrisiko des Kindes im späteren Leben; dargestellt ist das relative Risiko (OR, odds ratio mit 95 % Konfidenzintervall): kombiniert: 0,75 (0,69 – 0,82)
Eine weitere Metaanalyse zeigte, dass die Stilldauer einen starken Einfluss auf das Risiko späteren Übergewichts hat6. Bis zu einer Dauer von neun Monaten führt Stillen zu einer Senkung des Übergewichtsrisikos im späteren Leben: Jeder Monat des Stillens reduziert das Risiko des Kindes später Übergewicht zu entwickeln um 4 Prozent. Ab circa nach sieben bis neun Monaten wird ein Plateau erreicht (siehe Abbildung 3).
 Abbildung 2: Metaanalyse zum Zusammenhang zwischen Stilldauer und späterem Übergewichtsrisiko des Kindes; dargestellt sind kombinierte (gepoolte) relative Risiken (OR, odds ratios mit 95 % Konfidenzintervall) für Übergewicht bei unterschiedlicher Stilldauer.
Abbildung 2: Metaanalyse zum Zusammenhang zwischen Stilldauer und späterem Übergewichtsrisiko des Kindes; dargestellt sind kombinierte (gepoolte) relative Risiken (OR, odds ratios mit 95 % Konfidenzintervall) für Übergewicht bei unterschiedlicher Stilldauer.
Weitere Informationen sowie Studienergebnisse zum Stillen und zur Vorbeugung weiterer Krankheiten finden Sie auf unserer Seite „Muttermilch und Muttermilchforschung”.
Rolle einer niedrigen Eiweißzufuhr
Industriell hergestellte Säuglingsnahrungen haben einen höheren Eiweißgehalt als Muttermilch. Die aktuelle Gesetzgebung erlaubt einen Eiweißgehalt in Säuglingsnahrungen von 1,8 bis 2,5 Gramm/100 kcal.
Eine niedrige Eiweißzufuhr von 1,8 Gramm /100 kcal im gesamten ersten Lebensjahr führt zu einem niedrigeren Gewichtsstatus der Kinder im Alter von sechs Monaten sowie ein und zwei Jahren, im Vergleich zu einer deutlich höheren Eiweißzufuhr von 2,9g/100 kcal (s. Abb. 1). Diese Entwicklung setzte sich auch in der Folgeuntersuchung nach sechs Jahren fort.
Weitere Studien sind allerdings erforderlich, um den Effekt einer niedrigen Eiweißzufuhr auf die Gesundheit eines Säuglings zu erforschen und um tatsächlich eine Gewichtsentwicklung wie nach Muttermilchernährung zu erreichen8; 9. Nichtsdestotrotz gilt heute eine klare Präferenz für Säuglingsnahrungen mit einem niedrigen Eiweißgehalt, aber hoher Eiweißqualität10.
Auswirkungen mütterlicher Erkrankungen auf das Geburtsgewicht
Adipositas der Mutter während der Schwangerschaft erhöht das Risiko für Gestationsdiabetes (GDM), Präeklampsie, erhöhte Kaiserschnittrate sowie für Frühgeburten11; 12 und Allergien.
Neuere Untersuchungen zeigen, dass bei bis zu 20 % aller Schwangeren in Deutschland ein GDM besteht13. Kinder diabetischer Mütter weisen wiederum deutlich erhöhte mittlere Geburtsgewichte und ein zum Teil dramatisch erhöhtes Makrosomierisiko auf 14-19.
Ursache dafür ist, dass ein erhöhter Blutzuckerspiegel der Schwangeren den des Fötus ansteigen lässt, was wiederum zu einem Anstieg des fetalen Insulinspiegels führt. Dieser fetale Hyperinsulinismus ist für die vermehrte Fettzunahme in utero und damit für die Makrosomie verantwortlich20.
Durch einen systematischen Review auf der Basis von 35 Studien aus 16 Ländern auf vier Kontinenten mit insgesamt 980.450 Personen wurde bestätigt, dass ein höheres Geburtsgewicht mit einem erhöhten Übergewichtsrisiko im Erwachsenenalter assoziiert ist21. Eine Kohortenstudie22 mit 22.846 Probanden konnte nachweisen, dass sich das Geburtsgewicht linear positiv zum relativen Körpergewicht im Alter von 60 bis 65 Jahren verhält (siehe Abbildung 4).
 Abbildung 4: Zusammenhang zwischen Geburtsgewicht und Body-Mass-Index (BMI) im Erwachsenenalter
Abbildung 4: Zusammenhang zwischen Geburtsgewicht und Body-Mass-Index (BMI) im Erwachsenenalter
Diabetes Typ 2 bei Babys: Folge eines erhöhten Geburtsgewichts
Bereits das Übergewicht der Mutter während ihrer Schwangerschaft wirkt sich prägend auf die Gewichtsentwicklung ihres Kindes aus, aber auch der Ernährung von Säuglingen und Kleinkindern kommt eine zentrale Rolle zu. Aus diesem Grund sollte bereits früh in der kindlichen Ernährung darauf geachtet werden, eine zu schnelle Gewichtszunahme zu verhindern. Unser Perzentilenrechner hilft Ihnen bei der Einordnung des Gewichtes von Säuglingen und Kindern.
Stillen gilt als die optimale Form für die Ernährung des Säuglings, auch unter dem Aspekt der Gewichtsentwicklung und der damit zusammenhängenden Entwicklung von Typ-2-Diabetes. Für nicht oder nicht voll gestillte Säuglinge sollte daher erforscht werden, welche Bestandteile der Muttermilch diesen positiven Effekt ausmachen. Neben der Eiweißmenge und -qualität könnten auch Kohlenhydrate und ihre Verstoffwechselung eine Rolle spielen.
In weiteren Studien konnte auch ein Zusammenhang zwischen dem Geburtsgewicht, als Indikator der vorgeburtlichen Energiezufuhr, und dem späteren Typ-2-Diabetesrisiko nachgewiesen werden. Hier zeigt sich, dass sowohl ein niedriges als auch ein hohes Geburtsgewicht zu einem um circa 40 % erhöhten Risiko führen, im späteren Leben an Diabetes mellitus Typ 2 zu erkranken23. Ursache hierfür scheint, im Sinne einer epigenetischen Prägung, eine perinatale Fehlprogrammierung zentralnervöser Regelsysteme von Nahrungsaufnahme, Körpergewicht und Stoffwechsel zu sein.
Herz-Kreislauferkrankungen durch frühkindliches Übergewicht
Nicht nur bei der Entwicklung von Typ-2-Diabetes, sondern auch bei kardiovaskulären Erkrankungen (Herz-Kreislauf-Erkrankungen) spielt frühkindliches Übergewicht eine zentrale Rolle.
Einflussreiche „Stellgrößen“ der Bestandteile der Muttermilch könnten hierbei die Eiweißmenge und -qualität sowie die Fettzusammensetzung sein.
Eine Verminderung des diastolischen Blutdrucks in der Gesamtpopulation um nur 2 mm HG reduziert die Prävalenz von Bluthochdruck um 17 %, das Risiko für koronare Herzkrankheiten um 6 % und das für Schlaganfall um 15 %24.
Ausführliche Informationen können Sie in den Abschnitten „Einfluss der Ernährung auf das Immunsystem” und „Einfluss der Ernährung auf das Gehirn“ weiter unten nachlesen.
Vorbeugung von Gestationsdiabetes der Mutter
Gestationsdiabetes der Mutter kann weitreichende Komplikationen mit sich bringen – sowohl für die Mutter als auch für ihr Kind. Die Blutzuckerwerte sind in diesem Falle überstiegen, was wiederum Auswirkungen auf den Stoffwechsel der Mutter, aber auch des noch ungeborenen Kindes haben kann. Eine ausgewogene, gesunde Ernährung der Mutter wird daher empfohlen.
Gestationsdiabetes: Symptomarm und daher häufig unbemerkt
Nach neuesten Untersuchungen beträgt die Prävalenz in Deutschland 13,2 %25. Auf der Basis einer genetischen Prädisposition spielen vor allem das Übergewicht der Mutter und ihr Lebensstil (Ernährung und Bewegung) eine Rolle26. Da der Schwangerschaftsdiabetes, anders als ein Typ-2 Diabetes, keine Symptome wie etwa ein starkes Durstgefühl oder häufigen Harndrang verursacht, sondern überwiegend symptomarm verläuft, wird er von der Schwangeren häufig nicht bemerkt. Dass das Screening auf GDM in Form eines Blutzucker-gestützten Verfahrens seit einigen Jahren Kassenleistung ist, hat erheblich zur Verbesserung der GDM-Diagnostik beigetragen.
Frühe Diagnose und Therapie wichtig
Bleibt der GDM unbehandelt, kann dies schwerwiegende Folgen für die werdende Mutter und das Kind haben: So haben betroffene Frauen unter anderem ein erhöhtes Risiko für schwangerschaftsinduzierte Hypertonie oder Harnwegsinfekte. Zudem ist ihr Risiko, im späteren Leben einen Diabetes zu entwickeln, erhöht26.
Beim ungeborenen Kind kann es aufgrund des „zu viel“ an Glukose zu einer verstärkten Insulinproduktion und zur Makrosomie kommen. Auch neonatale Hypoglykämie, Hypokalzämie oder Hyperbilirubinämie gehören zu den möglichen Folgen. Zudem erhöht sich die Fruchtwassermenge durch eine vermehrte Urinproduktion des Kindes, was das Risiko für eine Frühgeburt erhöht. Die Zahl von Kaiserschnittgeburten ist bei Frauen mit GDM außerdem höher als bei gesunden Schwangeren26. Eine möglichst frühzeitige Diagnose und Therapie sind daher von großer Bedeutung, um das Risiko für Mutter und Kind zu senken.
Oraler Glukosetoleranztest (oGTT) als Goldstandard
Während zur GDM-Diagnose früher ein Urinzucker-Screening erfolgte, bei dem jedoch bei vielen Betroffenen der GDM nicht erkannt wurde, wird heute im Rahmen der Mutterschaftsrichtlinien ein Blutzucker-gestütztes Verfahren angewendet.
Gestationsdiabetes-Werte: Ab wann gelten sie als erhöht?: Bei jeder Schwangeren zwischen 24+0 und 27+6 SSW wird ein 50-g-Suchtest (Glucose Challange Test, GCT) angeboten. Ein Blutglukosewert von ≥ 135 mg/dl (7,5 mmol/l) eine Stunde nach Ende des Trinkens der Testlösung gilt als positives Screening und erfordert einen anschließenden diagnostischen 75-g-oralen-Glukosetoleranztest (oGTT). Dieses Procedere wird als zweizeitiges Screening bezeichnet, da zur Diagnosestellung ein zweiter Test benötigt wird. Nur wenn der Blutglukosewert nach dem 50-g-Belastungstest > 200 mg/dl (11,1 mmol/l) liegt, wird die Diagnose GDM direkt gestellt und ein oGTT ist obsolet.
Ergibt der Suchtest, der zwischen der 24. und der 28. Schwangerschaftswoche – bei erhöhtem Risiko bereits im ersten Trimenon – erfolgen sollte, erhöhte Blutzuckerwerte (ab 135 mg/dl bis 200 mg/dl), dann sollte zeitnah ein 75-g oGTT vorgenommen werden, der als „Goldstandard“ für die Diagnose des GDM gilt26.
S3-Leitlinie Gestationsdiabetes mellitus (GDM)
In der aktuellen S3-Leitlinie wird von den Fachgesellschaften empfohlen bei allen Schwangeren nur den 75 g – oGTT durchzuführen, da der 50 g Suchtest, der unabhängig von Tageszeit und Nahrungsaufnahme erfolgt, in seiner Validität angezweifelt wird26.
Danach liegt ein Gestationsdiabetes vor, wenn einer der folgenden Werte im 75-g-oGTT erreicht ist:
- 1. Nüchtern: > 92 mg/dl (5,1 mmol/l)
- 2. 1-Stunde: ≥ 180 mg/dl (10,0 mmol/l)
- 3. 2-Stunden: > 153 mg/dl (8,5 mmol/l)
Lebensstiländerungen als primäre Therapie
Da eine ungesunde und unausgewogene Ernährung eine der Hauptursachen des GDM ist, sind diätetische Maßnahmen als Therapie in der Regel unumgänglich. Zu empfehlen ist die Ernährung mit viel Obst, Gemüse und Lebensmitteln auf Vollkornbasis, tierische Fette sollten dagegen nur in Maßen eingenommen werden. Da Adipositas ein bedeutender Risikofaktor für eine verschlechterte Insulinwirkung ist, sollten Schwangere auf eine angemessene Gewichtszunahme achten, jedoch während der Schwangerschaft auch nicht versuchen abzunehmen27. Mehr zur Ernährung in der Schwangerschaft haben wir hier zusammengefasst.
Studien belegen zudem die Wirksamkeit von sportlicher Betätigung in der Schwangerschaft (definiert als dreimal pro Woche, jeweils 30 min über den Zeitraum von sechs Monaten oder mehr): So brachten Frauen mit GDM, die körperlich aktiv waren, signifikant seltener ein Large for Gestational Age (LGA)-Kind zur Welt als Frauen mit GDM, die sich nicht sportlich betätigten28. Reichen Lebensstiländerungen nicht aus, kann es notwendig werden, dass Schwangere mit GDM Insulin spritzen.
Einfluss der Ernährung auf das Immunsystem
Zum Zeitpunkt der Geburt ist das Immunsystem des Kindes noch unreif und muss nach und nach zu einem balancierten System heranreifen. Gelingt dies, können Probleme des Immunsystems, wie Allergien oder Abwehrschwächen, im späteren Leben verringert werden. Dabei spielt auch die Ernährung eine wichtige Rolle.

Immunabwehr entwickelt sich im Laufe der Jahre
Immunzellen entwickeln sich im ersten Trimester der Schwangerschaft. Einige dieser Zellen durchlaufen in dieser Zeit enorme Phasen der Reifung, beispielsweise um die Fähigkeit zu erwerben, spezifische Krankheitserreger zu erkennen und zu bekämpfen. Der größte Teil der Immunreifung geschieht noch vor dem Schulalter, die volle Kapazität wird allerdings erst im zweiten Lebensjahrzehnt erworben.
Zum Zeitpunkt der Konzeption wird das mütterliche Immunsystem herunterreguliert, um eine Abstoßung des sich einnistenden Kindes zu verhindern. Dieser veränderte mütterliche Immunstatus bildet den Ausgangspunkt für die Entwicklung des kindlichen Immunsystems und erklärt, warum das Immunsystem von Neugeborenen noch so anfällig für Infektionen und andere Störungen der Immunentwicklung ist.
Der größte Teil der menschlichen Abwehrmechanismen verschlechtert sich unter Fehlernährung, insbesondere bei einem Mangel an bestimmten Mikronährstoffen.
Beispiele für eine „Fehlprogrammierung“ des Immunsystems durch Ernährung finden sich bei intrauteriner Wachstumsretardierung, mütterlichem Mangel an Mikronährstoffen (Vitamine A, D, Folsäure und Zink) sowie unzureichender Säuglingsernährung.
Der Mangel an essentiellen Nährstoffen beeinflusst die sich schnell vermehrenden T-Zellen, einer spezifischen Art von Immunzellen. Starke und chronische Mangelernährung kann sogar zum Abbau des Thymus, dem Basisorgan des Immunsystems, führen29.
Eine ausgewogene Ernährung der Mutter während der Schwangerschaft und während der Stillzeit sowie die Ernährung im ersten Lebensjahr und die Ernährung im Kleinkindalter sind besonders wichtig, da hier die Basis für die spätere Immunabwehr des Kindes gelegt wird.
Stillen hat positiven Effekt auf immunologische Prozesse
Muttermilch erfüllt durch die besondere Zusammensetzung eine Vielzahl an Funktionen, die sich positiv auf das kindliche Immunsystem auswirken. Unter anderem besitzt sie antimikrobielle Eigenschaften und reduziert dadurch die Häufigkeit gastrointestinaler Infektionen im Säuglingsalter30. Werden Säuglinge beispielsweise länger als vier Monate gestillt, zeigen sie im Vergleich zu nicht gestillten Säuglingen weniger Infektionen der Atemwege, die im Krankenhaus behandelt werden müssen31.
Weiterhin kann Stillen vor Harntrakt- und Mittelohrentzündungen schützen. Wissenschaftliche Untersuchungen zeigen auch, dass Muttermilchernährung entzündliche Prozesse wie Allergien verhindern kann32 und vor chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn und Colitis Ulcerosa schützt33. Viele dieser positiven Eigenschaften der Muttermilch wirken weit über die Zeit des Stillens hinaus.
Weitere Studienergebnisse über die Wirksamkeit von Muttermilch auf das kindliche Immunsystem finden Sie in unserem Artikel rund ums Stillen.
Rolle der langkettigen, mehrfach ungesättigten Fettsäuren (LCP)
Etwa 25 % der Lipide in Immunzellen enthalten langkettige, mehrfach ungesättigte Fettsäuren (LCP)34-36. Daher kommt ihnen eine Schlüsselrolle für Immunzellen zu.
Aus wissenschaftlicher Sicht hat ein ausgewogenes LCP-Profil der Immunzellen eine hohe Bedeutung für deren optimale Regulierung und Reifung sowie für eine angemessene Immunantwort auf Stimuli. Auf der anderen Seite ist bekannt, dass ein suboptimales LCP-Profil zu einer unausgewogenen Entwicklung und Funktion des Immunsystems führen kann, beispielsweise zu einer unangemessen hohen Immunreaktion wie bei Allergien oder zu einer erhöhten Infektionsanfälligkeit37.
Interventionsstudien bei Kindern weisen darauf hin, dass LCP die Reifung und Funktion von Lymphozyten beeinflussen, die einen wichtigen Teil des Immunsystems darstellen38; 39. Dies ist insbesondere in Phasen schnellen Wachstums und hoher Entwicklung relevant, wie sie in der Säuglings- und Kleinkindzeit vorliegen40. Während dieser Phasen konkurriert das Immunsystem mit anderen Geweben, wie dem Herz-Kreislauf- oder dem zentralen Nervensystem, um die zur Verfügung stehenden LCP.
Noch fehlen gut geplante klinische Studien bei Säuglingen, die den Zusammenhang zwischen LCP und dem Immunsystem zeigen. Trotzdem gibt es bereits heute eindeutige wissenschaftliche Hinweise darauf, dass LCP ein hohes Potenzial haben, Gesundheitseffekte im Immunsystem für Neugeborene und ältere Kinder zu haben.
Oligosaccharide: eine gesunde Darm-Mikrobiota für die Immunabwehr
Die Entwicklung einer gesunden Darm-Mikrobiota im Säuglingsalter ist entscheidend, um bereits früh die Vielzahl an krankheitserregenden Keimen zu vermindern. Eine gesunde Darm-Mikrobiota im Säuglingsalter sorgt für ein stabiles und gesundes Darmmilieu auch im späteren Alter, was Voraussetzung für eine gute Infektabwehr41; 42 sowie Schutz vor Allergien ist42-44.
Humane Milch-Oligosaccharide (HMOs) stellen die drittgrößte Gruppe von Inhaltsstoffen in Muttermilch dar. Diese Oligosaccharide liegen in über 200 unterschiedlichen Strukturen in der Muttermilch vor und haben verschiedene positive Effekte für Säuglinge.
Dazu zählen das Fördern einer bifidogenen Darm-Mikrobiota, der Schutz vor pathogenen Bakterien und damit auch der Schutz vor Infektionen und Entzündungen. Die Besonderheit von HMOS liegt in ihrer Vielfalt und die vielen verschiedenen Strukturen. So liegen etwa 90 % der Strukturen in kurzkettiger Form vor und etwa 10 % in langkettiger Form. Durch diese Kombination stärken HMOs den gesamten Darmtrakt des Säuglings und dessen Immunsystem45; 46.
In unserer Aptamil Muttermilchforschung konnte eine prebiotische Mischung entwickelt werden, die das Verhältnis von kurzkettigen und langkettigen Strukturen und die Funktionalität der Muttermilch-Oligosaccharide imitiert.
- Die spezielle Kombination von 90 % kurzkettigen Galacto-Oligosacchariden (scGOS; Polimerisationsgrad von 3-8 Galaktosemolekülen) und 10 % langkettigen Fructo-Oligosacchariden (lcFOS; Polimerisationsgrad von mehr als 23 Fruktosemolekülen) ähnelt Muttermilch-Oligosacchariden in ihrer Molekulargröße sowie -verteilung47; 48
- Wissenschaftliche Untersuchungen zeigen, dass Säuglingsnahrungen mit scGOS/lcFOS (im Verhältnis 9:1) gesundheitsfördernde Effekte auf chemische, mechanische, biologische und immunologische Ebenen der menschlichen Abwehr haben. Sie fördern den Aufbau einer bifidogenen Darm-Mikrobiota, ähnlich wie bei Muttermilchernährung49.
- Weiterhin fördern sie die Entstehung von kurzkettigen Fettsäuren (engl. short-chain fatty acids; SCFA) im Darm, die zu einem niedrigen pH-Wert führen, der die Vermehrung von pathogenen Keimen erschwert50; 51.
- Dieses intestinale SCFA-Muster verstärkt den Schutz durch die intestinale Darmbarriere (mechanische Abwehr)52-54.
- Neueste Erkenntnisse zeigen, dass Säuglingsnahrungen die eine Kombination aus scGOS/lcFOS und HMOs enthalten (s. Abb. 2) einen positiven Einfluss auf Darm- und Immunparameter haben, gut verträglich sind und zu Stühlen ähnlich denen gestillter Kinder führen 55-58.
- In Studien mit Aptamil-Säuglingsnahrungen mit scGOS/lcFOS (9:1) in einer Konzentration von 0,8g/100ml zeigte sich, dass diese Nahrungen die Inzidenz an weit verbreiteten Infektionen, an Fieberepisoden sowie Antibiotikaverschreibungen verringern59-62.
Diese Gesundheitseffekte konnten bisher über einen Zeitraum von fünf Jahren gezeigt werden62.
Atopische Erkrankungen bei Säuglingen: Einfluss von Stillen und Säuglingsnahrungen
Die Entstehung von Nahrungsmittelallergien von Kindern kann schon früh beeinflusst werden, sowohl im positiven als auch im negativen Sinne, was zu langfristigen Auswirkungen auf die Gesundheit führen kann. Stillen wird in diesem Zusammenhang oft mit einer verminderten Häufigkeit atopischer Erkrankungen assoziiert. Dies ist auch häufig Gegenstand der Forschung. Doch die Datenlage hierzu ist derzeit widersprüchlich.
Stillen hat viele Vorteile für Mutter und Kind und ist die beste Ernährung für Babys. Von allen Fachgesellschaften wird Stillen daher empfohlen. Aus den Daten lässt sich allerdings nicht ableiten, dass Stillen zu einem geringeren Risiko für die Entstehung von Allergien beim Kind führt, so die wissenschaftliche Arbeitsgruppe Prävention der Gesellschaft für Pädiatrische Allergologie und Umweltmedizin (GPA). In der kürzlich aktualisierten S3-Leitlinie wird darauf hingewiesen, dass das Meiden bestimmter Lebensmittel während der Stillzeit keinen positiven Effekt in Hinblick auf die Entwicklung von Allergenen beim Kind hat. Dabei seien auch Lebensmittel eingeschlossen, die häufig Auslöser von Allergien sein.
Besuchen Sie auch unsere Seite zu „Alle Informationen rund ums Stillen“ und „Säuglingsernährung und Darm-Mikrobiota“ für weitere Informationen zum Thema Allergieprävention, Darm-Mikrobiota und Immunsystem.
In Studien mit Aptamil-Säuglingsnahrungen mit scGOS/lcFOS (9:1) in einer Konzentration von 0,8g/100 ml konnte klinisch nachgewiesen werden, dass die Fütterung dieser Nahrungen in den ersten Lebensmonaten die Inzidenz der atopischen Dermatitis noch nach zwei beziehungsweise fünf Jahren verringert59; 60; 62.
Einfluss der Ernährung auf das Gehirn
Die Basis für ein leistungsfähiges Gehirn wird bereits in frühester Kindheit gelegt, sogar schon vor der Geburt. Die Ernährung liefert die Grundstoffe dafür63 und spielt daher eine entscheidende Rolle.
Einfluss von Ernährung auf die Gehirnentwicklung von Babys
Die Basis für ein leistungsfähiges Gehirn wird bereits in frühester Kindheit gelegt, sogar schon vor der Geburt, in einer Phase schnellen Wachstums und enormer Zellspezialisierung. Der fortwährende Auf- und Umbau des Gehirns sowie die pausenlose Kommunikation zwischen Neuronen machen das Gehirn zu dem Organ mit dem höchsten Energiebedarf. Die Ernährung liefert die Grundstoffe dafür und spielt daher eine entscheidende Rolle für seine Entwicklung.
Wenn ein sich entwickelnder Fötus zu wenig oder zu viel eines bestimmten Nährstoffs erhält, kann sich dadurch die Gehirnstruktur verändern, was wiederum die kognitiven Fähigkeiten beeinträchtigen kann.
Stillen beeinflusst die geistige Entwicklung positiv
Eine Vielzahl von Studien mit gestillten und flaschenernährten Kindern zeigte positive Zusammenhänge zwischen Stillen und geistiger Entwicklung, mit langfristigen Auswirkungen bis ins Erwachsenenalter64-66. Auch das Geburtsgewicht scheint eine Rolle für die positive Wirkung des Stillens auf die Gehirnentwicklung zu spielen: In der United Kingdom Millennium Cohort Study führte Stillen zu einer verbesserten kognitiven Entwicklung insbesondere bei Frühgeborenen67.
Ausschließliches Stillen verbessert Entwicklung von Sprache, Emotion und Kognition
Eine Studie fand unter Verwendung einer speziellen Gehirn-Magnetresonanztomographie (MRT) mögliche Hinweise darauf, dass ausschließliches Stillen, im Vergleich zu nicht oder nur teilweisem Stillen, das Wachstum der weißen Gehirnsubstanz (fettreiche Membranen der Nervenfasern, eine der Grundvoraussetzungen für schnelle Signalleitung) um 20 bis 30 % steigern kann68.
Ausschließliches Stillen für mindestens drei Monate führt hier im Alter von zwei Jahren zu einer verbesserten Entwicklung in Bereichen des Gehirns, denen Sprache, Emotionen und Kognition zugeordnet werden. Säuglinge, die länger als ein Jahr gestillt wurden, zeigten ein signifikant erhöhtes Hirnwachstum in den Arealen für Motorik.
Die gestillten Kinder zeigten später erhöhte Sprachfähigkeit, Sehvermögen und motorische Kontrolle. Diese Effekte könnten auf die unterschiedliche Zusammensetzung von Muttermilch und Flaschennahrung zurückgeführt werden, zum Beispiel auf die Fettsäuren und ihre Verstoffwechselung.
Eine Studie, in der Mütter während der Stillzeit vermehrt die DHA in Form von Fisch zu sich nahmen, ergab, dass längere Stilldauer mit verbessertem Sprachverständnis im Alter von drei Jahren sowie mit verbesserter verbaler und nonverbaler Intelligenz mit sieben Jahren verbunden war69. Gestillte Säuglinge von Müttern, die mindestens zwei Portionen Fisch pro Woche aßen, zeigten mit drei Jahren bessere Visio-motorische Fähigkeiten.
Eine andere Studie fand Assoziationen zwischen dem Stillen, Polymorphismen im FADS2-Gen (das eine Rolle im Fettsäurestoffwechsel spielt) und höherem Bildungserfolg im Alter von zwölf Jahren, weniger überaktivem Verhalten mit drei Jahren sowie einen Trend zu einem höheren Intelligenzquotienten70.
Gehirnentwicklung auch durch äußere Einflüsse geprägt
Auch andere Umweltfaktoren haben Einfluss das Wachstum und die funktionelle Entwicklung des Gehirns in den ersten Lebensjahren. Die Vorteile des Stillens scheinen unter anderem durch Faktoren wie Geburtsalter, Geschlecht und genetischen Hintergrund beeinflusst zu werden. Studien zeigen, dass emotionale Gesundheit, physischer Kontakt mit den primären Bezugspersonen, stimulierender Augenkontakt und Kommunikation in der frühen Lebensphase wichtige Faktoren für die strukturelle Entwicklung und Stimulation des Gehirns darstellen und somit essentiell für die geistigen Fähigkeiten eines Kindes im späteren Leben sind.
LCP: Verbesserung der kognitiven Fähigkeiten
Nicht nur für die Immunabwehr spielt LCP eine Rolle, sondern auch für die kognitive Entwicklung. Etwa vom Beginn des dritten Schwangerschaftstrimesters bis zu einem Alter von zwei Jahren legt das Gehirn einen Wachstumsspurt ein. Der Peak liegt um den Zeitpunkt der Geburt 71. In dieser Periode steigt der Gehalt an der LCP-Fettsäure DHA (Docosahexaensäure) dramatisch durch Zellvermehrung und DHA-Einlagerung an72.
DHA und Gehirnentwicklung hängen demnach eng zusammen. Seit 2020 zählt daher die mehrfach ungesättigte Omega-3-Fettsäure Docosahexaensäure (DHA) laut aktueller EU-Verordnung zu einem verpflichtenden Zusatzstoff in Anfangs- und Folgenahrungen. Weitere Informationen dazu finden Sie in unserer Broschüre „Die neue EU-Verordnung – Was sie darüber wissen sollten (2020)”.
Obwohl Säuglinge einen gewissen Anteil an DHA selbst aus Vorläuferfettsäuren synthetisieren können73-76, geschieht dies jedoch nur langsam und nicht ausreichend. Deshalb sind Säuglinge auf eine DHA-Zufuhr über die Ernährung angewiesen. Mit der DHA-Zufuhr muss auch für eine ausreichende Zufuhr an der LCP-Fettsäure AA (Arachidonsäure) gesorgt werden, da sowohl DHA als auch AA um dieselben Enzyme konkurrieren (siehe Abbildung 7).
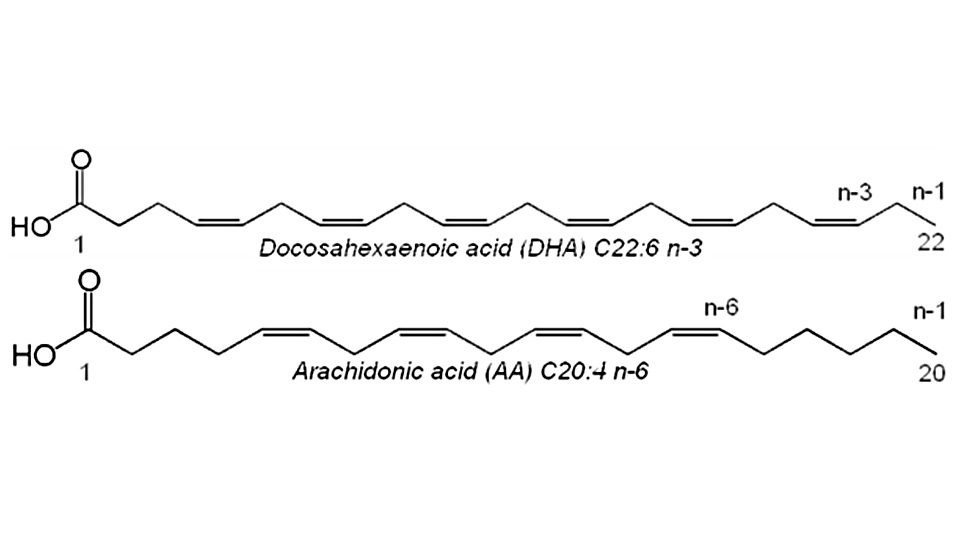 Abbildung 7: Die beiden wichtigsten LCPs in Muttermilch: DHA und AA. DHA besteht aus 22 Kohlenstoffatomen mit 6 Doppelbindungen – die erste an der Position n-3. AA besteht aus 20 Kohlenstoffatomen mit 4 Doppelbindungen – die erste an der Position n-6.
Abbildung 7: Die beiden wichtigsten LCPs in Muttermilch: DHA und AA. DHA besteht aus 22 Kohlenstoffatomen mit 6 Doppelbindungen – die erste an der Position n-3. AA besteht aus 20 Kohlenstoffatomen mit 4 Doppelbindungen – die erste an der Position n-6.
Gestillte Säuglinge haben höhere DHA-Konzentrationen im Gehirn im Vergleich zu Säuglingen, die Nahrungen ohne DHA-Supplementierung erhielten77; 78. Man vermutet, dass der höhere DHA-Status gestillter Säuglinge für bessere kognitive Fähigkeiten dieser Kinder verantwortlich sein könnte66. Diese verbesserten geistigen Fähigkeiten scheinen bis ins Erwachsenenalter anzudauern79.
In einer klinischen Studie zeigten Kinder mit sechs Jahren, die als Säuglinge in den ersten vier Lebensmonaten eine Aptamil Säuglingsnahrung mit LCP erhielten oder gestillt wurden, im Vergleich zu Kindern ohne LCP in den ersten Lebensmonaten, eine wesentlich schnellere Reaktion beim „matching familiar figures test“, bei dem Kinder kleinste Unterschiede bei Zeichnungen identifizieren sollen80. Auch in anderen Intelligenztests waren sie effizienter beim Verstehen und Lösen von Problemen. Dies könnte große Bedeutung für die Lernfähigkeit in der Schule haben. Mehr zu Aptamil Säuglingsnahrung.
Hier finden Sie Informationen zu Aptamil und zu unserem Produktsortiment. Laden Sie sich Informationen zum Download herunter oder bestellen Sie Ihr Infomaterial postalisch. Abonnieren Sie hier unseren Newsletter.
Zusammenhang zwischen Eisen und Gehirnentwicklung
Unter Eisenmangel (Sideropenie) sowohl in utero als auch postnatal, kann es zu einer gestörten und teilweise irreversiblen Entwicklung der Gehirnstruktur und -funktion kommen, da Eisen essenziell für die Entstehung und Ausdifferenzierung von Gehirnzellen und bestimmten Hirnregionen ist81; 82.
Nicht-anämischer Eisenmangel ist bei Kleinkindern in entwickelten Ländern weit verbreitet. Daten aus den USA, Neuseeland und sieben europäischen Regionen zeigen, dass viele Kinder einen niedrigen Eisenstatus haben, mit steigender Tendenz83-85. Verzehrsdaten der DONALD-Studie weisen darauf hin, dass circa 30 % aller Kleinkinder in Deutschland nicht ausreichend mit Eisen versorgt sind86. Auf die Aspekte einer ausgewogenen Eisenversorgung gehen wir umfangreicher unter dem Thema „Ernährung im ersten Lebensjahr” sowie „Kleinkindernährung ab dem ersten Lebensjahr” ein.
Cholin in der Schwangerschaft für gesunde fetale Hirnentwicklung
Cholin ist ein wichtiger Baustein in den Nervenmembranen und spielt eine Rolle für das Gedächtnis. Hohe Cholinkonzentrationen im Gehirn und Rückenmark sind wichtig für den Verschluss des Neuralrohrs und die Gehirnentwicklung. Eine bedarfsdeckende Cholinversorgung während der Schwangerschaft wird sowohl bei Tieren als auch bei Menschen mit einer gesunden fetalen Hirnentwicklung assoziiert, mit langfristig positiven Auswirkungen auf geistige Funktionen, einschließlich Gedächtnis, und erfährt daher erhöhte Aufmerksamkeit für eine pränatale Anwendung87; 88.
Einfluss auf Geschmacksentwicklung
Die frühkindliche Geschmacksentwicklung beginnt bereits intrauterin und setzt sich in den ersten Lebensjahren fort.
Die spätere Präferenz für bestimmte Lebensmittel hängt sowohl von der frühen Geschmacks- und Geruchssensitivität des Kindes ab, als auch von seinem erlernten Verhalten sowie seiner frühkindliche Prägung – die unter anderem von der Ernährung der Mutter während der Schwangerschaft, aber auch durch die Prägung der Außenwelt – abhängt.
Ein Teil menschlicher Nahrungspräferenzen kann über die Gene erklärt werden. Einen weiteren Einfluss üben die intrauterinen Umgebungsfaktoren aus, wie der Effekt der morgendlichen Übelkeit in der frühen Schwangerschaft auf die Salzpräferenz des Kindes oder Geschmacksstoffe im Fruchtwasser während späterer Phasen der Schwangerschaft89.
Frühe Nahrungspräferenzen partiell bis ins Erwachsenenalter
Longitudinal-Studien weisen darauf hin, dass Nahrungspräferenzen im Alter von zwei bis drei Jahren prägend für die spätere Kindheit sind – für bestimmte Lebensmittel sogar bis ins Erwachsenenalter90; 91.
Eine wiederholte Exposition des Säuglings an neue Nahrungsmittel während der Beikostphase ist wichtig und kann die Akzeptanz dieser Nahrungsmittel erhöhen. Dies sollte vorzugsweise noch vor dem dritten Lebensjahr geschehen, bevor üblicherweise die Phase der Ablehnung und des Trotzes beginnt, damit die Akzeptanz einer großen Bandbreite an Lebensmitteln erleichtert wird90; 91
Aromaprofile der Muttermilch
Schon lange diskutiert man die besondere Bedeutung spezifischer Geruchs- und Geschmacksprofile der Muttermilch für die frühkindliche sensorische Entwicklung. Die Hypothese ist, dass die mütterliche Ernährung die sensorischen Eigenschaften von Muttermilch wesentlich bestimmt, dass diese sensorischen Eigenschaften weiterhin einen unmittelbaren Effekt auf die Säuglinge haben und sich zusätzlich auf die späteren Ernährungsgewohnheiten der Kinder auswirken können.
Allerdings ist bisher nur wenig über die molekulare Zusammensetzung der verantwortlichen Geruchssubstanzen in der Milch bekannt. Chemische und verhaltensbiologische Studien zu diesem Thema waren bisher geprägt durch hohe Geruchsstoff-Dosierungen beziehungsweise langfristige Supplementierung der Mütter mit den jeweiligen Aromen oder Nahrungsmitteln, so dass eine Übertragung auf die alltägliche Ernährungssituation nur schwer möglich ist92.
Sensorische Veränderung der Muttermilch nicht zwangsläufig von mütterlicher Ernährung abhängig
Neuere Untersuchungen geben erste Anhaltspunkte, in welchem Maße Geruchsstoffe in die Muttermilch übergehen, ob sie durch den mütterlichen Stoffwechsel eine Modifizierung erfahren und werfen die Frage auf, wie sich mögliche Metabolite auf den kindlichen Stoffwechsel auswirken.
Als wesentliche Befunde ergaben sich, dass die zugrunde liegenden chemischen und physiologischen Vorgänge wesentlich komplexer sind als in vielen Studien bisher angenommen, und dass auch Metabolisierungen im mütterlichen Organismus eine wichtige Rolle spielen können92.
Ein wichtiges Ergebnis war unter anderem, dass nicht jedes von der Mutter verzehrte Aroma auch zwingend zu sensorischen Veränderungen der Muttermilch führt. So konnte gezeigt werden, dass Fisch- oder Stilltee-Geruchsstoffe weder analytisch noch sensorisch in der Muttermilch nachweisbar waren93.
Ausnahme: höhere Konzentrationen können Aroma der Muttermilch beeinflussen
Eine klare Veränderung wurde dagegen beobachtet, wenn stillende Mütter höher dosierte Geruchsstoffmengen aufnahmen, zum Beispiel im Falle einer Erkältung bei Einnahme höherer Mengen Eukalyptol. In dieser Situation wurde in der Tat ein Übergang von Eukalyptol in die Muttermilch beobachtet, wobei aber auch zusätzliche, durch den mütterlichen Organismus generierte Metabolite in der Muttermilch nachweisbar waren94-96.
Sie haben Fragen?
Aptacare Expertenteam – Immer für Sie und Eltern da
Das Aptacare Expertenteam steht Ihnen und (werdenden) Eltern jederzeit kompetent bei Fragen rund um Schwangerschaft, Stillen, Ernährung von Baby und Kleinkind sowie mit Informationen zu unseren Produkten zur Verfügung.
Stillen ist das Beste für Babys. Säuglingsnahrungen sollten nur auf Rat von Kinderärzten oder Kinderärztinnen oder anderem medizinischen Fachpersonal verwendet werden.
- Baird, J., Fisher, D., Lucas, P., Kleijnen, J., Roberts, H., Law, C. Being big or growing fast: systematic review of size and growth in infancy and later obesity. BMJ 2005;331:929
- Reilly, J., Armstrong, J., Dorosty, A., Emmett, P., Ness, A., Rogers, I., Steer, C., Sherriff, A., Team, A. L. Early life risk factors for obesity in childhood: cohort study. BMJ 2005;330:1357
- Monteiro, P., Victora, C. Rapid growth in infancy and childhood and obesity in later life--a systematic review. Obes Rev 2005;6:143-54
- Ong, K., Loos, R. Rapid infancy weight gain and subsequent obesity: systematic reviews and hopeful suggestions. Acta Paediatr 2006;95:904-8
- Plagemann, A., Harder, T. Breast feeding and the risk of obesity and related metabolic diseases in the child. Metab Syndr Relat Disord 2005;3:222-32
- Harder, T., Bergmann, R., Kallischnigg, G., Plagemann, A. Duration of breastfeeding and risk of overweight: a meta-analysis. Am J Epidemiol 2005;162:397-403
- Koletzko, B., von Kries, R., Closa, R., Escribano, J., Scaglioni, S., Giovannini, M., Beyer, J., Demmelmair, H., Gruszfeld, D., Dobrzanska, A., Sengier, A., Langhendries, J., Rolland Cachera, M., Grote, V., Group, E. C. Lower protein in infant formula is associated with lower weight up to age 2 y: a randomized clinical trial. Am J Clin Nutr 2009;89:1836-45
- Günther, A., Buyken, A., Kroke, A. Protein intake during the period of complementary feeding and early childhood and the association with body mass index and percentage body fat at 7 y of age. Am J Clin Nutr 2007;85:1626-33
- Wells, J., Stanley, M., Laidlaw, A., Day, J., Davies, P. Energy intake in early infancy and childhood fatness. Int J Obes Relat Metab Disord 1998;22:387-92
- Koletzko, B., Beyer, J., Brands, B., Demmelmair, H., Grote, V., Haile, G., Gruszfeld, D., Rzehak, P., Socha, P., Weber, M., Group, E. C. Early influences of nutrition on postnatal growth. Nestle Nutr Inst Workshop Ser 2013;71:11-27
- Cedergren, M. Maternal morbid obesity and the risk of adverse pregnancy outcome. Obstet Gynecol 2004;103:219-24
- Sebire, N., Jolly, M., Harris, J., Wadsworth, J., Joffe, M., Beard, R., Regan, L., Robinson, S. Maternal obesity and pregnancy outcome: a study of 287,213 pregnancies in London. Int J Obes Relat Metab Disord 2001;25:1175-82
- Engel, C., Simon, J., Schwuchow, C., Glaser, H. Screening auf Gestationsdiabetes – eine prospektive Multicenterstudie in Osthessen. Diabetologie 2006;1:56
- Lee, A., Hiscock, R., Wein, P., Walker, S., Permezel, M. Gestational diabetes mellitus: clinical predictors and long-term risk of developing type 2 diabetes: a retrospective cohort study using survival analysis. Diabetes Care 2007;30:878-83
- Casey, B., Lucas, M., Mcintire, D., Leveno, K. Pregnancy outcomes in women with gestational diabetes compared with the general obstetric population. Obstet Gynecol1997;90:869-73
- Crowther, C., Hiller, J., Moss, J., McPhee, A., Jeffries, W., Robinson, J., Group, A. C. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med2005;352:2477-86
- Günter, H., Scharf, A., Hertel, H., Hillemanns, P., Wenzlaff, P., Maul, H. Perinatale Morbidität in Schwangerschaften von präkonzeptionellen Diabetikerinnen und Gestationsdiabetikerinnen im Vergleich mit Nichtdiabetikerinnen. Ergebnisse der niedersächsischen Perinatalerhebung. Z Geburtsh Neonatol 2006;210:200-7
- Kwik, M., Seeho, S., Smith, C., McElduff, A., Morris, J. Outcomes of pregnancies affected by impaired glucose tolerance. Diabetes Res Clin Pract 2007;77:263-8
- Langer, O., Rodriguez, D., Xenakis, E., McFarland, M., Berkus, M., Arrendondo, F. Intensified versus conventional management of gestational diabetes. Am J Obstet Gynecol1994;170:1036-46
- Lepercq, J., Hauguel-De Mouzon, S., Timsit, J., Catalano, P. Fetal macrosomia and maternal weight gain during pregnancy. Diabetes Metab 2002;28:323-8
- Plagemann A, Dudenhausen JW. Ernährung und frühe kindliche Prägung. In:Ernährungsbericht 2008. DGE . Deutsche Gesellschaft für Ernährung e. V. 2008 Bonn, 271-300
- Curhan, G., Willett, W., Rimm, E., Spiegelman, D., Ascherio, A., Stampfer, M. Birth weight and adult hypertension, diabetes mellitus, and obesity in US men. Circulation1996;94:3246-50
- Harder, T., Plagemann, A., Harder, A. Birth weight and subsequent risk of childhood primary brain tumors: a meta-analysis. Am J Epidemiol 2008;168:366-73
- Singhal, A., Lucas, A. Early origins of cardiovascular disease: is there a unifying hypothesis. Lancet 2004;363:1642-5
- Melchior et al. Dtsch Ärztebl. Int. 2017;114(24):412-8
- S3-Leitlinie Gestationsdiabetes (GDM), Diagnostik, Therapie und Nachsorge, 2.Auflage. DGG, DGGG-AGG 2018
- http://www.diabetes-ˇratgeber.net/Diabetes-ˇSchwangerschaft/Schwangerschaftsdiabetes-ˇGestationsdiabetes-ˇ28090_2.html ,zuletzt abgerufen am 18.09.2017
- Baratzat et al- 2013. Bt J Sports Med 42(10):630-6
- Palmer, D., Metcalfe, J., Prescott, S. Preventing disease in the 21st century: the importance of maternal and early infant diet and nutrition. J Allergy Clin Immunol 2012;130:733-4
- Chirico, G., Marzollo, R., Cortinovis, S., Fonte, C., Gasparoni, A. Antiinfective properties of human milk. J Nutr
- Bachrach, V., Schwarz, E., Bachrach, L. Breastfeeding and the risk of hospitalization for respiratory disease in infancy: a meta-analysis. Arch Pediatr Adolesc Med 2003;157:237-43
- Fiocchi, A., Martelli, A., De Chiara, A., Moro, G., Warm, A., Terracciano, L. Primary dietary prevention of food allergy. Ann Allergy Asthma Immunol 2003;91:3-12
- Hanson, L. Session 1: Feeding and infant development breast-feeding and immune function. Proc Nutr 2007;66:384-96
- Rees, D., Miles, E., Banerjee, T., Wells, S., Roynette, C., Wahle, K., Calder, P. Dose-related effects of eicosapentaenoic acid on innate immune function in healthy humans: a comparison of young and older men. Am J Clin Nutr 2006;83:331-42
- Yaqoob, P., Pala, H., Cortina-Borja, M., Newsholme, E., Calder, P. Encapsulated fish oil enriched in alpha-tocopherol alters plasma phospholipid and mononuclear cell fatty acid compositions but not mononuclear cell functions. Eur J Clin Invest 2000;30:260-74
- Thies, F., Nebe-von-Caron, G., Powell, J., Yaqoob, P., Newsholme, E., Calder, P. Dietary supplementation with gamma-linolenic acid or fish oil decreases T lymphocyte proliferation in healthy older humans. J Nutr 2001;131:1918-27
- Koletzko, B., Lien, E., Agostoni, C., Böhles, H., Campoy, C., Cetin, I., Decsi, T., Dudenhausen, J. W., Dupont, C., Forsyth, S., Hoesli, I., Holzgreve, W., Lapillonne, A., Putet, G., Secher, N. J., Symonds, M., Szajewska, H., Willatts, P., Uauy, R. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med 2008;5–14
- Field, C., Thomson, C., Van Aerde, J., Parrott, A., Euler, A., Lien, E., Clandinin, M. Lower proportion of CD45R0+ cells and deficient interleukin-10 production by formula-fed infants, compared with human-fed, is corrected with supplementation of long-chain polyunsaturated fatty acids. J Pediatr Gastroenterol Nutr 2000;31:291-9
- Field, C., Van Aerde, J., Robinson, L., Clandinin, M. Effect of providing a formula supplemented with long-chain polyunsaturated fatty acids on immunity in full-term neonates. Br J Nutr 2008;99:91-9
- Field, C., Clandinin, M., Van Aerde, J. Polyunsaturated fatty acids and T-cell function: implications for the neonate. Lipids 2001;36:1025-32
- Oozeer, R., van Limpt, K., Ludwig, T., Ben Amor, K., Martin, R., Wind, R.,Boehm, G., Knol, J. Intestinal microbiology in early life: specific prebiotics canhave similar functionalities as human-milk oligosaccharides. Am J Clin Nutr 2013;98:561S-71S.
- Kaplan, J., Shi, H., Walker, W. The role of microbes in developmental immunologic programming. Pediatr Res 2011;69:465-72.
- Vael, C., Nelen, V., Verhulst, S., Goossens, H., Desager, K. Early intestinal Bacteroides fragilis colonisation and development of asthma. BMC Pulm Med 2008;26:19.
- Martin, R., Nauta, A., Ben Amor, K., Knippels, L., Knol, J., Garssen, J. Early life: gut microbiota and immune development in infancy. Benef Microbes 2010;1:367-82.
- Thur S, et al. 2017. Nutrition Reviews 75(11): 929-33.
- Stahl B, et al. 1994. Anal Biochem 223: 218-28.
- Boehm G, Stahl B. Oligosaccharides. In: Functional dairy products. Mattila-Sandholm T. Woodhead Publ 2003 Cambridge.
- Stahl, B., Thurl, S., Zeng, J., Karas, M., Hillenkamp, F., Steup, M., Sawatzki, G. Oligosaccharides from human milk as revealed by matrix-assisted laserdesorption/ionization mass spectrometry. Anal Biochem 1994;223:218-26.
- Boehm, G. L., Casetta, P., Jelinek, J., Negretti, F., Stahl, B., Marini, A. Supplementation of an oligosaccharide mixture to a bovine milk formula increasescounts of faecal bifidobacteria in preterm infants. Arch Dis Child 2002;86:F178-81.
- Knol, J., Scholtens, P., Kafka, C., Steenbakkers, J., Groß, S., Helm, K., Klarczyk, M. S., Böckler, H., Wells, J. Colon microflora in infants fed formula with galacto-and fructo-oligosaccharides: more like breast-fed infants. J Pediatr GastroenterolNutr 2005a;40:36-42.
- Knol, J., Boehm, G., Lidestri, M., Negretti, F., Jelinek, J., Agosti, M., Stahl, B., Marini, A., Mosca, F. Increase of faecal bifidobacteria due to dietaryoligosaccharides induces a reduction of clinically relevant pathogen germs in thefaeces of formula-fed preterm infants. Acta Paediatr Suppl 2005b;94:31-3.
- Scholtens, P., Alliet, P., Raes, M., Alles, M., Kroes, H., Boehm, G., Knippels, L., Knol, J., Vandenplas, Y. Fecal secretory immunoglobulin A is increased inhealthy infants who receive a formula with short-chain galacto-oligosaccharidesand long-chain fructo-oligosaccharides. J Nutr 2008;138:1141-7.
- Moro, G., Minoli, I., Mosca, M., Fanaro, S., Jelinek, J., Stahl, B., Boehm, G.Dosage-related bifidogenic effects of galacto- and fructooligosaccharides informula-fed term infants. J Pediatr Gastroenterol Nutr 2002;34:291-5.
- Willemsen, L., Koetsier, M., van Deventer, S., van Tol, E. Short chain fatty acidsstimulate epithelial mucin 2 expression through differential effects onprostaglandin E(1) and E(2) production by intestinal myofibroblasts. Gut2003;52:1442-7.
- Rodríguez-Herrera A, et al. Accepted for oral presentation at the ESPGHAN conference; 9–12 May 2018 in Geneva, Switzerland.
- Tims S, et al. 2018. J Pediatr Gastroenterol Nutr 66 (Supp. 2):884–5.
- Herrera AR, et al. 2015. J Pediatr Gastroenterol Nutr 61: 516–7.
- Rodríguez-Herrera A, et al. 2016. J Pediatr Gastroenterol Nutr 62 (Supp. 1): abstract G-P-230: 422.
- Arslanoglu, S., Moro Guido, E., Boehm, G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6months of life. J Nutr 2007;137:2420–4.
- Arslanoglu, S., Moro, G., Schmitt, J., Tandoi, L., Rizzardi, S., Boehm, G. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces theincidence of allergic manifestations and infections during the first two years of life.J Nutr 2008;138:1091–5.
- Bruzzese, E., Volpicelli, M., Squeglia, V., Bruzzese, D., Salvini, F., Bisceglia, M., Lionetti, P., Cinquetti, M., Iacono, G., Amarri, S., Guarino, A. A formula containinggalacto- and fructo-oligosaccharides prevents intestinal and extra-intestinalinfections: an observational study. Clin Nutr 2009;28:156-61.
- Arslanoglu, S., Moro, G., Boehm, G., Wienz, F., Stahl, B., Bertino, E. Earlyneutral prebiotic oligosaccharide supplementation reduces the incidence of someallergic manifestations in the first 5 years of life. J Biol Regul Homeost Agents2012;26:49-59.
- O'Brien, J., Sampson, E. Lipid composition of the normal human brain: gray matter, white matter, and myelin. J Lipid Res 1965;6:537-44
- Oddy, W., Li, J., Whitehouse, A., Zubrick, S., Malacova, E. Breastfeeding duration and academic achievement at 10 years. Pediatrics 2011;127:e137-45
- Drane, D., Logemann, J. A critical evaluation of the evidence on the association between type of infant feeding and cognitive development. Paediatr Perinat Epidemiol 2000;14:349-56
- Anderson, J., Johnstone, B., Remley, D. Breast-feeding and cognitive development: a meta-analysis. Am J Clin Nutr 1999;70:525-35
- Quigley, M., Hockley, C., Carson, C., Kelly, Y., Renfrew, M., Sacker, A. Breastfeeding is associated with improved child cognitive development: a population-based cohort study. J Pediatr 2012;160:25-32 Deoni, S.
- Dean, D. 3., Piryatinsky, I., O'Muircheartaigh, J., Waskiewicz, N., Lehman, K., Han, M., Dirks, H. Breastfeeding and early white matter development: A cross-sectional study. Neuroimage 2013;15:77-86
- Belfort, M., Rifas-Shiman, S., Kleinman, K., Guthrie, L., Bellinger, D., Taveras, E., Gillman, M., Oken, E. Infant feeding and childhood cognition at ages 3 and 7 years: Effects of breastfeeding duration and exclusivity. JAMA Pediatr 2013;167:836-44
- Groen-Blokhuis, M., Franic, S., van Beijsterveldt, C., de Geus, E., Bartels, M., Davies, G., Ehli, E., Xiao, X., Scheet, P., Althoff, R., Hudziak, J., Middeldorp, C., Boomsma, D. A prospective study of the effects of breastfeeding and FADS2 polymorphisms on cognition and hyperactivity/attention problems. Am J Med Genet B Neuropsychiatr Genet 2013;162B:457-65
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early Hum Dev 1979;3:79-83
- Lauritzen, L., Hansen, H., Jørgensen, M., Michaelsen, K. The essentiality of long chain n-3 fatty acids in relation to development and function of the brain and retina. Prog Lipid Res 2001;40:1-94
- Demmelmair, H., von Schenck, U., Behrendt, E., Sauerwald, T., Koletzko, B. Estimation of arachidonic acid synthesis in full term neonates using natural variation of 13C content. J Pediatr Gastroenterol Nutr 1995;21:31-6
- Carnielli, V., Luijendijk, I., Van Goudoever, J., Sulkers, E., Boerlage, A., Degenhart, H., Sauer, P. Structural position and amount of palmitic acid in infant formulas: effects on fat, fatty acid, and mineral balance. J Pediatr Gastroenterol Nutr 1996;23:553-60
- Salem, N. J., Wegher, B., Mena, P., Uauy, R. Arachidonic and docosahexaenoic acids are biosynthesized from their 18-carbon precursors in human infants. Proc Natl Acad Sci U S A 1996;93:49-54
- Sauerwald, T.,Hachey, D., Jensen, C., Chen, H., Anderson, R., Heird, W. Intermediates in endogenous synthesis of C22:6 omega 3 and C20:4 omega 6 by term and preterm infants. Pediatr Res 1997;41:183-7
- Farquharson, J., Cockburn, F., Patrick, W., Jamieson, E., Logan, R. Infant cerebral cortex phospholipid fatty-acid composition and diet. Lancet 1992;340:810-3
- Makrides, M., Neumann, M., Byard, R., Simmer, K., Gibson, R. Fatty acid composition of brain, retina, and erythrocytes in breast- and formula-fed infants. Am J Clin Nutr 1994;60:189-94
- Mortensen, E., Michaelsen, K., Sanders, S., Reinisch, J. The association between duration of breastfeeding and adult intelligence. JAMA 2002;287:2365-71
- Willatts, P., Forsyth, S., Agostoni, C., Casaer, P., Riva, E., Boehm, G. Effects of long-chain PUFA supplementation in infant formula on cognitive function in later childhood. Am J Clin Nutr 2013;98:536S-42S
- Lozoff, B., Beard, J., Connor, J., Barbara, F., Georgieff, M., Schallert, T. Long-lasting neural and behavioral effects of iron deficiency in infancy. Nutr Rev 2006;64:S34-43
- McCann, J., Ames, B. An overview of evidence for a causal relation between iron deficiency during development and deficits in cognitive or behavioral function. Am J Clin Nutr 2007;85:931-45
- Bamberg, R. Occurrence and detection of iron-deficiency anemia in infants and toddlers. Clin Lab Sci 2008;21:225-31
- Freeman, V., Mulder, J., van't Hof, M., Hoey, H., Gibney, M. A longitudinal study of iron status in children at 12, 24 and 36 months. Public Health Nutr 1998;1:93-100
- Male, C., Persson, L., Freeman, V., Guerra, A., van't Hof, M., Haschke, F., Group, E. I. Prevalence of iron deficiency in 12-mo-old infants from 11 European areas and influence of dietary factors on iron status (Euro-Growth study). Acta Paediatr 2001;90:492-8
- Kersting M, Clausen K. Ernährungsphysiologische Auswertung einer repräsentativen Verzehrsstudie bei Säuglingen und Kleinkindern VELS mit dem Instrumentarium der DONALD Studie. In: Schlussbericht. Forschungsinstitut für Kinderernährung 2003 Dortmund
- Zeisel, S. The fetal origins of memory: the role of dietary choline in optimal brain development. J Pediatr 2006;149:S131-6
- Wu, B., Dyer, R., King, D., Richardson, K., Innis, S. Early second trimester maternal plasma choline and betaine are related to measures of early cognitive development in term infants. PLoS One 2012;7:e43448
- Nicolaïdis, S. Prenatal imprinting of postnatal specific appetites and feeding behavior. Metabolism 2008;57 Suppl 2:S22-6
- Maier, A., Chabanet, C., Schaal, B., Leathwood, P., Issanchou, S. Food-related sensory experience from birth through weaning: contrasted patterns in two nearby European regions. Appetite 2007;49:429-40
- Wardle, J., Herrera, M., Cooke, L., Gibson, E. Modifying children's food preferences: the effects of exposure and reward on acceptance of an unfamiliar vegetable. Eur J Clin Nutr 2003;57:341-8
- Büttner, A. Aromaprofile der Muttermilch. Forum Kompakt 2013;4:1-2
- Sandgruber, S., Much, D., Amann-Gassner, U., Hauner, H., Buettner, A. Sensory and molecular characterisation of human milk odour profiles after maternal fish oil supplementation during pregnancy and breastfeeding. Food Chemistry 2011;128:485-
- Kirsch, F., Buettner, A. Characterisation of the Metabolites of 1,8-Cineole Transferred into Human Milk: Concentrations and Ratio of Enantiomers. Metabolites2013;3:Metabolites
- Kirsch, F., Horst, K., Röhrig, W., Rychlik, M., Büttner, A. Tracing metabolite profiles in human milk: Studies on the odorant 1,8-cineole transferred into breast milk after oral intake. Metabolomics 2013;9:483-96
- Kirsch, F., Beauchamp, J., Büttner, A. Time-dependent aroma changes in breast milk after oral intake of a pharmacological preparation containing 1,8-cineole.Clin Nutr 2012;31:682-92


